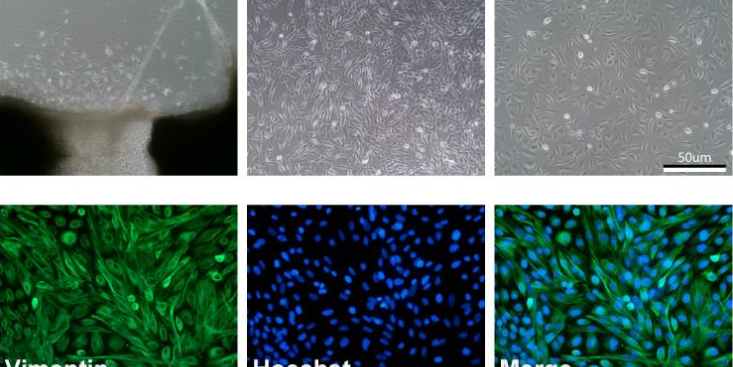
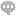血管生长是发生的关键步骤。无论原发性还是继发性,一旦生长直径超过1~2mm,都会有血管生成,这是由于细胞自身可分泌多种生长因子,诱导血管生成。由于组织这种新生血管结构及功能异常,且血管基质不完善,这种微血管容易发生渗漏,因此细胞不需经过复杂的侵袭过程而直接穿透到血管内进入血流并在远隔部位形成转移。越来越多的研究表明,良性血管生成稀少,血管生长缓慢;而大多数恶性的血管生成密集且生长迅速,因此,血管生成在的发展转移过程中起到重要作用,抑制这一过程将能明显阻止组织的发展和扩散转移。血管生成实验的技术原理主要是应用Matrigel模拟机体环境,上面接种细胞,观察血管生成情况。体外的血管生成实验能很好的模拟的血管发生过程,并且适合研究药物对这一过程的影响实验。我们以HUVEC细胞为例,介绍这一实验的详细过程。1、主要步骤Step1:细胞培养Step2:细胞转染或药物处理Step3:铺Matrigel胶Step4:接种细胞Step5:观察血管生成情况实验过程中需要注意:1、实验前一天需要将Matrigel置于冰盒,放入冰箱中,同时需要准备一些预冷的头用于吸取Matrigel胶;2、将Matrigel胶加到血管生成载玻片时注意头要垂直于内孔的正上方加入Matrigel。足细胞呈星型多突状,胞体较大,由胞体伸出许多突起,呈指状交叉覆盖于肾小球基底膜外表面。上海酒精肝原代细胞分离培养
上期我们主要讲解了细胞凋亡的早期检测方法,这期主要讲解一下细胞凋亡晚期中,核酸内切酶(某些Caspase的底物)在核小体之间剪切核DNA,产生大量长度在180-200bp的DNA的片段。1、凋亡DNALadder检测试剂盒细胞经处理后,采用常规方法分离提纯DNA,进行琼脂糖凝胶和溴化乙啶染色,在凋亡细胞群中可观察到典型的DNAladder。QuickApoptoticDNALadderDetectionKit可以快速(约1-2小时)、灵敏地检测凋亡细胞中的DNA的片段。2、TUNEL-basedDNA的片段分析试剂盒细胞凋亡中,染色体DNA双链断裂或单链断裂而产生大量的粘性3-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3-末端,从而可进行凋亡细胞的检测。Apo-BrdUTM分析使用2种颜色的TUNEL方法用流式细胞仪检测凋亡细胞中DNA条带。采用的BrdU比生物素标记的或地高辛(digoxigenylated)标记的方法灵敏度更高。3、Caspase分析试剂和试剂盒Caspase在细胞凋亡中发挥着重要的作用,属于天冬氨酸蛋白酶。其中caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥功能。在正常状态下,caspase家族都以无活性的酶原。上海肺病原代细胞分离培养哪家好肝脏星状细胞占肝脏固有细胞总数的15 %,占非实质细胞的30%左右。

1、取新鲜抗凝全血(EDTA、枸橼酸钠或肝素抗凝血均可)或者去纤维蛋白血液,用等体积的全血及组织稀释液或者PBS稀释全血。2、取一支无菌离心管,先加入试剂A,再加入试剂D,使两者形成梯度界面(试剂A:试剂D的体积比为3:2,如稀释后的血液样本小于5ml,则先后加入3ml试剂A和2ml试剂D;如稀释后的血液样本大于5ml,试剂总量与稀释后的血液样本量相等),两种试剂的分层一定要清晰。3、将稀释后的血液平铺到分离液液面上方,注意保持两液面界面清晰。(可以使用巴氏德吸管吸取血液,然后将血液小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。如果样品较多,加样的时间较长,在离心之前出现红细胞成团下沉属正常现象)4、室温,水平转子500~800g,离心20~30min(血液的体积越大所需的离心力越大,离心时间越长,的分离条件需自行摸索,离心转速不超过1000g)。5、离心后将出现明显的分层:层为血浆层;第二层为白色单核细胞层;第三层为透明试剂D液层;第四层为半透明试剂A液层;第五层为红细胞层(如图示)。6、小心吸取第二层白色单核细胞层到另一无菌的15ml离心管中,加入10mL细胞洗涤液或PBS,颠倒混匀,250g,离心10min。7、弃上清。
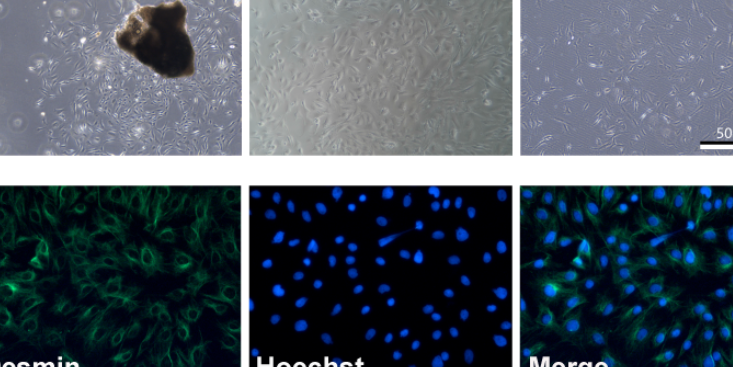
注意事项1.病毒包装的几个关键点主要包括:细胞因素、载体系统(尽量使用成熟的商业化载体系统)、构建重组的质粒正确与否、质粒抽提纯化情况、包装转染控制(24、48小时的细胞及荧光状态判断)、目的基因对病毒包装影响(基因大小、序列情况、蛋白功能毒性等都会影响到是否能包装成功)。,需要观察包装病毒后的48h培养基颜色是否橙红。3.病毒浓缩:病毒一般在48h和72h各收一次。如果不想浓缩病毒的话,也可以直接将收集的病毒上清作为要的细胞的培养基,但是可能效果会不太好。并且一般收病毒时,培养基的营养已经损耗了很多,那样直接培养细胞会损害细胞,所以建议还是进行浓缩后再。常见问题1.包装病毒时293T细胞状态不好,或者铺得过密,可以选择放弃该次实验。2.目的载体过大,不易。3.避免转染过程以及后续过程出现的污染。大鼠主动脉内皮细胞(aortic endothelial cells)组成了主动脉内壁,并持续受到血流剪切应力的影响。
1、取细胞县液100u加入Transwel小室。2、24孔板下室一般加入600u含20S的培养基,特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱其至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。3、培养细胞:常规培养12-48h(主要依细胞侵袭能力而定)。24h较常见,时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。直接计数法贴壁”细胞计数,这里所谓的“贴“是指细胞穿过膜后,可以附着在膜的下室侧而不会掉到下室里面去,通讨给细胞染色可在镜下计数细胞。取出Transwel小室,弃去孔中培养液,用无钙的PBS洗2遍,用醇固定30分钟,将小室适当风干。01%结晶紫染色20min,用棉签轻轻掉上层未江移细胞,用PBS洗3遍。400倍显微镜下随即五人视野观察细胞,记数。可以鉴定原代细胞的外包公司。上海酒精肝原代细胞分离培养
胃平滑肌细胞的主要作用是通过肌肉的收缩蠕动向胃内推进食物。上海酒精肝原代细胞分离培养
并进质粒抽提。GAG质粒和VSV质粒同样可以转化至感受态细菌DH5α中,并进行无内质粒抽提。质粒抽提后冷冻于-20℃保存。2、慢病毒包装1)使用DMEM完全培养基培养6cm皿HEK293T至汇合度为70~80%。采用opti-MEM和Lipo3000分别转染含有目的基因的pMSCV-eGFP、VSV、GAG质粒及对照载体,每皿加入脂质体-质粒转染混悬液按购买脂质体相关说明书操作定量。继续培养24h。2)24小时后,将培养基更换为新鲜的DMEM完全培养基,放进细胞培养箱继续培养48~72h。3)48~72h后收集上层培养液,并过μm滤膜,采用ELISA法对所获得的慢病毒载体进行病毒滴度测定。如不及时使用可以冻存于-80℃。3、慢病毒转染1)转染前1天将细胞接种6孔培养板,时细胞的融合率约为50%,前需换液,加入1mLDMEM完全培养基。2)病毒冰浴融化后加入相应体积的病毒液及聚凝胺(Polybrene),混匀后放入37℃孵箱中继续培养3)4h后补充1mL培养基,14h后换液(24h内换液即可)。4)病毒72h后用倒置显微镜观察荧光,监测效率,出现较多荧光时将等量的转染细胞和未转染细胞分别加入等浓度Puromycin(Puromycin或其他筛选浓度需要事先摸索)。5)待未转染细胞全部死亡并且可观察到满意荧光量时,降低Puromycin浓度培养。上海酒精肝原代细胞分离培养
文章来源地址: http://yyby.chanpin818.com/swzp/swzdsj/deta_28480415.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3