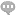在反应过程中,荧光染料或荧光标记的探针会与扩增产物结合。非特异性扩增产物,如引物二聚体等,也会与荧光物质发生一定程度的结合并产生荧光信号。通过实时监测荧光信号的变化,可以察觉到这些非特异性产物的存在。反应结束后进行熔解曲线分析。不同的扩增产物包括特异性产物和非特异性产物,在升温过程中会在不同的温度下解链,从而导致荧光信号的变化。非特异性产物如引物二聚体通常具有独特的熔解温度,通过分析熔解曲线的峰形和位置,可以判断是否存在非特异性扩增产物。内参法是利用已知浓度的内部标准物质来进行定量分析的方法。abi定量pcr

要确保 qPCR 结果的准确性和可靠性,需要严格控制实验的各个环节。从样本的采集和处理、引物和探针的设计,到反应条件的优化和数据分析,每一个步骤都至关重要。样本的质量直接影响结果的准确性。如果样本中存在杂质、抑制剂或降解的DNA,可能导致假阴性或不准确的定量结果。因此,样本的采集、保存和处理需要遵循严格的标准和规范。引物和探针的设计是qPCR成功的关键之一。它们需要具有高度的特异性,能够准确地结合目标序列,避免非特异性扩增。精心设计的引物和探针可以提高检测的准确性和灵敏度。abi定量pcr循环阈值的产生与扩增产品的起始浓度、引物的扩增效率、PCR条件等因素密切相关。

在数据分析方面,需要正确选择合适的定量方法和内参基因。内参基因的选择要谨慎,以确保其在不同样本中的表达相对稳定。随着技术的不断发展,qPCR也在不断进化和创新。例如,数字PCR技术的出现,进一步提高了定量的精度和准确性。它通过将样本分割成无数个微小的反应单元,实现对单个DNA分子的定量分析。此外,与其他技术的结合也拓展了qPCR的应用范围。比如与微流控技术结合,可以实现高通量、自动化的qPCR分析,提高了实验效率。
聚合酶链反应的热循环具有众多的优点和重要意义。它极大地提高了检测的灵敏度。通过多次循环的扩增,即使起始的 DNA 量非常少,也能够被放大到足以被检测和分析的程度。这使得我们能够在极其微小的样本中检测到特定的基因或 DNA 序列,为疾病诊断、遗传分析等领域提供了强大的工具。热循环的特异性使得我们能够准确地扩增目标 片段,而避免了对其他无关序列的扩增。这确保了检测结果的准确性和可靠性。聚合酶链反应的热循环具有高度的可重复性。只要严格控制反应条件,不同批次的实验可以得到几乎相同的结果,这对于科学研究和临床应用都至关重要。为了确保循环阈值的准确性,在进行 PCR 实验时,需要进行严格的实验设计和质量控制。

生成PCR产物熔解曲线图通常需要在实时荧光定量PCR仪器上进行。在PCR反应结束后,通过设置一个温度梯度,将PCR产物逐渐加热,同时监测荧光信号的变化。PCR产物在高温下容易发生熔解,形成单链DNA片段,导致荧光信号的降低。当所有DNA双链解离后,荧光信号将趋于稳定。在整个熔解曲线扫描的过程中,仪器会记录荧光信号随温度变化的曲线,终生成PCR产物熔解曲线图。PCR产物熔解曲线的生成需要注意一些技术细节。首先,设定合适的温度梯度和扫描速度,确保能够准确地捕获PCR产物的熔解过程。其次,进行PCR反应时,需要选择合适的引物和探针,确保PCR产物的特异性和准确性。此外,在分析熔解曲线时,需要注意排除干扰因素,如引物二聚体或非特异扩增产物的影响,以确保熔解曲线的准确性和可靠性。在实时荧光定量 PCR 技术中,Ct 值的确定对于定量分析起始模板的数量非常重要。abi定量pcr
判断扩增产物特异性的标准并不只有Ct 值大小,其他因素如引物设计等也会对扩增产物的特异性产生重要影响。abi定量pcr
聚合酶链反应(PolymeraseChainReaction,PCR),这一神奇的生物技术,在分子生物学领域引发了性的变革。而其中关键的步骤——高温变性、低温复性和适温延伸的热循环,更是整个过程的与精髓。让我们首先深入探究高温变性阶段。在这一阶段,反应体系被置于极高的温度下,通常在90℃至95℃之间。如此高的温度带来了什么呢?它导致了DNA双链的解离,就如同解开了一条紧密缠绕的绳索。原本稳定的双螺旋结构在高温的冲击下,碱基对之间的氢键断裂,两条链分离开来,成为了的单链。这一过程看似简单,却为后续的反应奠定了至关重要的基础。通过高温变性,我们打破了DNA分子的原有结构,使其处于一种可以被重新组合和构建的状态。abi定量pcr
文章来源地址: http://yyby.chanpin818.com/swzp/qtswzp/deta_24200491.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3