外泌体作为药物载体由于特殊的结构和循环方式,外泌体作为药物运输的载体具有独特的优势。例如外泌体的尺寸分布能够增强渗透滞留效应,从而有选择性地深入组织;其外层磷脂双分子层可以保护内容物不受各种生物酶的影响,维持各种生物分子的活性;外泌体普遍存在于各种体液和组织中,其体积小,结构、组成与细胞膜类似,导致外泌体可以在避开免疫系统监督的同时深入组织内部,有较好的生物相容性;当采用内源外泌体时,能明显降低其他药物载体可能引起的有害免疫反应;除此之外,某些细胞来源或经特殊修饰过的外泌体具有良好的特异性,可以与特定的或组织结合。因此,载药成为外泌体研究的一个重要分支,具有良好的应用前景。在外泌体中引入药物的方式包括体内装载和体外装载两种。体内药物装载可以通过传统方法(如病毒转染、脂质体转染或电穿孔等)转染来源细胞,编码感兴趣的RNA或蛋白质,也可以使药物与来源细胞共混,使细胞分泌产生含有目标生物分子的外泌体。体外药物装载则首先需要得到纯化的外泌体,然后将感兴趣的药物通过电穿孔或脂质体转染等方法装入纯化的外泌体。外泌体内可装载的药物包括小分子化学药物、蛋白质和多肽、核酸药物、天然产物等。可以稳定的WB精髓与经验分享。上海病理科研技术服务分离
采用opti-MEM和Lipo3000分别转染含有目的基因的pMSCV-eGFP、VSV、GAG质粒及对照载体,每皿加入脂质体-质粒转染混悬液按购买脂质体相关说明书操作定量。继续培养24h。2)24小时后,将培养基更换为新鲜的DMEM完全培养基,放进细胞培养箱继续培养48~72h。3)48~72h后收集上层培养液,并过μm滤膜,采用ELISA法对所获得的慢载体进行滴度测定。如不及时使用可以冻存于-80℃。3、慢转染1)转染前1天将细胞接种6孔培养板,时细胞的融合率约为50%,前需换液,加入1mLDMEM完全培养基。2)冰浴融化后加入相应体积的液及聚凝胺(Polybrene),混匀后放入37℃孵箱中继续培养3)4h后补充1mL培养基,14h后换液(24h内换液即可)。4)72h后用倒置显微镜观察荧光,监测效率,出现较多荧光时将等量的转染细胞和未转染细胞分别加入等浓度Puromycin(Puromycin或其他筛选浓度需要事先摸索)。5)待未转染细胞全部死亡并且可观察到满意荧光量时,降低Puromycin浓度培养。也可以挑去单克隆细胞株进行进一步培养,以得到满意的稳定表达目的基因的细胞株。6)使用qRT-PCR和Westernblot的方法检测目的基因的表达量和蛋白水平是否显著提高。7)由此可得三组细胞株:a.正常细胞株;b.空载载体的细胞株。上海疾病模型科研技术服务外包动物疾病模型还为科研人员提供了研究人类疾病的跨学科方法。
用伊红乙醇液对比染色1~3min。(4)将切片放入95%乙醇中洗去多余的红色,然后放入无水乙醇中3~5min,吸干后将切片放入二甲苯Ⅰ、Ⅱ中各3~5min。3、观察在镜下可见卵巢呈扁椭圆形,表面为单层扁平上皮细胞或单层立方上皮,卵巢实质分为皮质和髓质。可见上皮,原始卵泡和生长卵泡。卵巢组织中各发育阶段卵泡及卵巢基质的形态结构清晰可见,细胞核呈蓝紫色,细胞质及间质成分呈浅红色,卵泡中卵母细胞、卵泡细胞、透明带均清晰可见。注意事项1.取材注意事项(1)取材动作要迅速,不宜作太久的拖延以免组织细胞的成分、结构等发生变化。(2)切片材料应根据需要观察的部位进行选择,尽可能不要损伤所需要的部分。(3)切取的组织块不宜太大,以利于固定剂穿透,通常以5mmx5mmx2mm或10mmx10mmx2mm为宜。2.固定注意事项(1)一般固定液,都以新配为好,配好后应贮存在阴凉处,不宜放在日光下,以免引起化学变化,失去固定作用。(2)有些混合固定液的成份之间会发生氧化还原作用,一定要在使用前才混合,如果混合太早,固定时就没有作用了。(3)固定材料时,固定液必须充足,一般为材料块的20~30倍,有些水分多的材料,中间应更换1~2次新液。(4)材料固定完毕后。
如胰腺,一般取胰岛较多的胰腺尾部;肺应取有细支气管及带有软骨片的小支气管部。如果实验需进行多样本的采集,采集顺序应按照:消化,神经系统,皮肤,肌肉等的顺序进行。选好块的切面。熟悉某些成分安排,然后决定其切面的走向;如一长管状以横切面较好。切除不需要的部分。特别是周围的脂肪等,应尽可能掉,否则给固定、脱水、浸蜡、切片等带来一些不必要的问题。样品的固定(1)固定的方法:①小块固定法:从动物取下的小块,立即置入液态固定剂(这是应用经常的方法)。②注射/灌注固定法:某些块由于体积过大或固定液极难渗入内部或需要对整个脏器或整个动物进行固定,这时宜采用注射固定法,将固定液注入血管,经血管分支到达整个和全身,从而得到充分的固定。另,空腔比如肺,肺内含有空气,固定液难以渗入,建议先做肺灌注,使得肺充盈满固定液以后再进行保存,如果空腔中气体没有排出,后续可能影响固定效果(没有灌注的肺会浮在液体表面不利于固定,切片以后也会看到很多的空泡)。③蒸汽固定法:比较细小而薄的标本,可用锇酸或甲醛蒸汽固定。主要用于血液或细胞涂片以及某些薄膜的固定。。慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
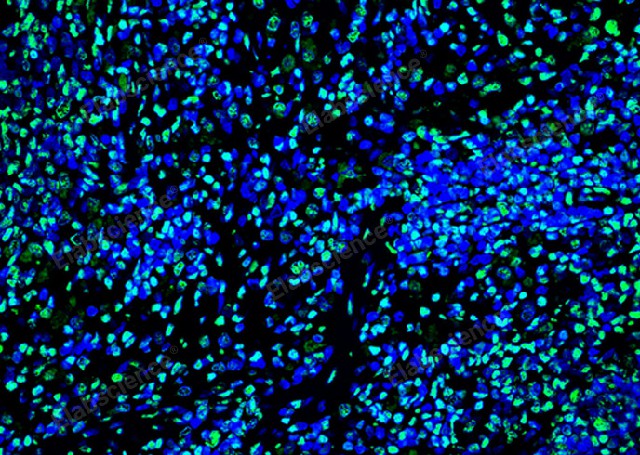
RNA各种可逆的化学修饰被认为是一种新的表观遗传调控方式。m6A是真核生物mRNA常见的化学修饰,在调控mRNA稳定性,剪切和翻译方面具有重要的作用。作者使用转录组测序发现了METTL3(甲基转移酶3),一种主要的RNAN6-腺苷-甲基转移酶,在人肝细胞(HCC)和多种实体中高表达。在临床上,METTL3的过度表达与肝细胞患者不良预有关。体外实验证明敲除METTL3会抑制HCC细胞增殖,迁移及克隆形成。体内实验证明敲除METTL3会明显抑制HCC体内成瘤和肺转移。另外,使用CRISPR/dCas9-VP64系统,内源性高表达METTL3会促进HCC细胞在体外和体内生长。通过转录组测序、m6A-Seq、MeRIP-PCR,作者确定了SOCS2(细胞因子信号2的抑制因子)作为METTL3介导的m6A修饰的下游靶基因。敲除METTL3表达会消除SOCS2mRNAm6A修饰并增强SOCS2mRNA表达。m6A介导的SOCS2mRNA降解是依赖于m6A“读取器”蛋白YTHDF2。总之,METTL3在HCC大部分高表达中,并通过m6A-YTHDF2依赖机制抑制SOCS2表达从而促进HCC进展。因此,作者发现了在肝发生过程中表观遗传改变的一种新机制。图4RNA甲基化转移酶METLLT3在肝组织中高表达。流式细胞周期检测试剂盒是一种用于研究细胞周期的重要工具。上海兔科研技术服务构建
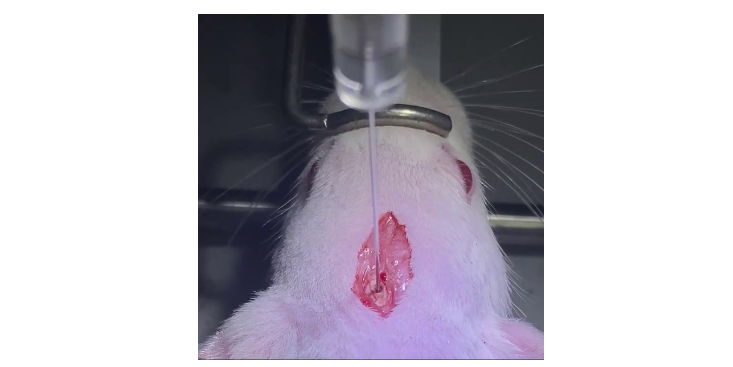
裸鼠皮下成瘤模型造模意义.上海病理科研技术服务分离
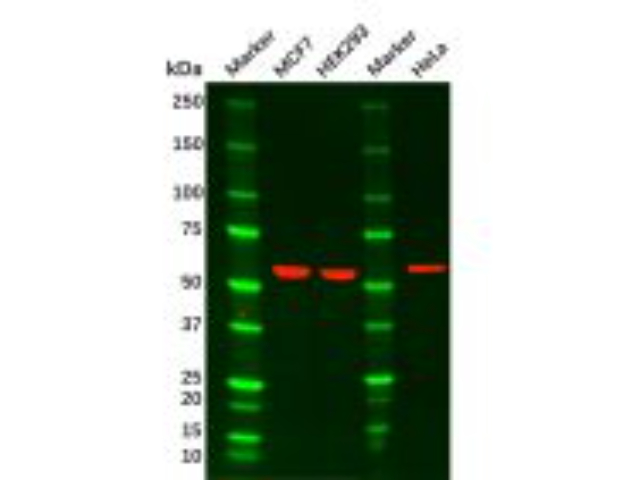
3)基因/蛋白质表达定性或定量检测在进行分子检测的过程中,保持核酸和蛋白质的完整性至关重要,因此在取样过程中,应尽量避免核酸及蛋白质的降解。如不注意采样过程,将会导致样本中的核酸及蛋白质的无差别降解,严重影响后续分子检测结果。在条件允许的情况下,样本在离体后应立刻装入冻存管内,并立即放入液氮中进行冷冻。在RNA提取样本的保存过程中,可以选择非冷冻型RNA保存液或Trizol试剂进行RNA酶的。针对蛋白质提取样本的保存,我们同样可以使用商品化的蛋白酶剂进行短期处理。聚合酶链式反应(PolymeraseChnReaction,PCR)及免印迹(Westernblotting,WB),这两种实验手段是分子学检测中不可或缺的一部分,也是发表至关重要的分子检测数据。PCR主要用来对基因在基因组层面或转录层面的变化进行定性或定量检测,而WB则主要用来对某一蛋白质的表达进行定量检测。(4)转录组学、蛋白质组学及代谢组学检测随着检测水平及相关产业的不断发展,各类组学检测的价格降低,实验设计中也常常运用组学检测来提升实验设计的档次。在我们进行转录组学及蛋白质组学的检测过程中,同样是要首先确保目标RNA或蛋白质的片段完整性。上海病理科研技术服务分离
文章来源地址: http://yyby.chanpin818.com/swzp/ktky/deta_26418668.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3