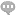从流程图可以看出,注册人UDI系统的两个基本输出是:1)提供一个附有UDI数据信息载体的器械;2)在udi数据库中声明和维护udi数据。步骤1制造商识别码的应用。厂商进行识别系统代码需要向编码管理机构申请,GS1的厂商识别代码我们可以在网上申办,办理渠道分析如下,任选其一:1)Onlinelogin)关注中国物品编码中心官方微信官方账号“中国码”,然后点击业务办理,通过微信进行业务办理和查询,得到业务办理进度提醒。3)下载中国物品编码中心的官方软件“中国码”应用程序,快速申请条码。Step2UDI赋码UDI赋码是确定医疗器械企业产品进行标识(DI)和生产安全标识(PI)的活动,包含DI赋码和PI确定。UDI应满足***性、稳定性和可扩展性的要求。1)***性是指医疗器械的***标识应与医疗器械的标识要求一致。2)稳定性,是指医疗器械***标识应当与产品进行基本结构特征以及相关,产品的基本信息特征未变化的,产品设计标识应当可以保持不变。3)可扩展性意味着医疗器械的独特识别应适应不断变化的法规要求和实际应用。(包括医用配件、医用耗材),明确公司目前用于营销、经营、生产、研发的适销产品标识,如产品型号、规格,梅州标识UDI实施、品号,梅州标识UDI实施,梅州标识UDI实施、参考号、物料代码等。 发行机构的系统必须符合UDI规则中的ISO标准。梅州标识UDI实施
医疗机构是医疗器械的使用方,汇集大量不同品种的医疗器械,不仅有作为固定资产管理的医疗设备,也有在手术过程中使用的一次性使用耗材,还有其他可重复使用的医疗器械产品。由于不同产品的使用特点不同,管理起来难度很大。***批实施***标识的医疗器械主要集中在高值耗材领域,第二批更多品种实施UDI后,将对医疗机构使用和管理医疗器械带来更多便利。医疗器械注册人和监管机构可及时了解医疗机构使用UDI的问题和需求,及时反馈应用过程中出现的问题,进一步优化UDI实施流程,充分发挥UDI的潜在价值。在医疗器械领域建设***标识系统,已被全球许多国家和地区的监管机构所认可,其搭建是一个涉及面广、工作量大、实施复杂、周期长的系统工程。随着第二批医疗器械产品实施***标识,我国UDI系统建设进入新阶段。相信随着系统建设日趋完善,UDI在促进医疗器械产业高质量发展方面将会发挥更多作用。 德阳UDI操作流程全国所有三类医疗器械在今年6月1日前,必须全部完成UDI实施.
近日,威高医用制品公司完成了威高医疗器械标识(以下简称“UDI”)所有的技术论证工作,所有产品的UDI编码工作已结束,建立了威高的UDI数据库,数据库与ERP系统和MES系统关联,实现了数据的共享与交互,至此,UDI工作提前进入到了实施阶段,威高医用制品公司在国内同行业率先实施了UDI管理。国家药品监督管理局于2018年12月25日发布了医疗器械行业标准《医疗器械标识基本要求》,实施日期为2020年1月1日,相关的法规《医疗器械标识系统规则》和标准《医疗器械标识系统术语与定义》《医疗器械标识数据库基本数据集》也即将发布,标志着我国医疗器械行业实施医疗器械标识已成定局。据悉,UDI由三部分组成:UDI编码、UDI数据载体和UDI数据库。UDI编码采用符合GS1标准的DataMatrix二维码形式,每一个规格的产品都拥有一个全球的标识码。该码作为产品的“电子身份证”,可以在产品制造过程、仓储物流过程、医院耗材管理、国家不良事件监管、产品召回等产品生命周期全过程实现自动识别、精细追溯,为实现产品供应链的信息化管理奠定了基础,将对产品供应链效率的优化产生深远的影响。
1医疗器械***标识数据库定义:数据库包含医疗器械的产品标识及相关数据。国家食品药品监督管理总局制定医疗器械***标识数据相关标准及规范,组织建立医疗器械***标识数据库,供公众查询。解释:NMPA负责建立一个数据库,供公众查询,就跟医疗器械产品数据库一样。02***标识数据的提交要求:注册人或者备案人应当在申请医疗器械注册或办理备案时,在注册/备案管理系统中提供申报产品的产品标识。注册人或者备案人应当在其产品获准注册、取得备案或者变更后30个工作日内,将产品标识及相关数据上传至医疗器械***标识数据库。解释:这里明确指出:产品注册/备案时需同时提交申报产品的产品标识且获得注册证或取得备案后录入标识数据库。这就意味着产品的UDI是需要备案的,就跟型号规格一样,不能随便更改。5UDI相关指南、标准及资料01总局办公厅公开征求医疗器械***标识系统规则(征求意见稿)意见02关于征求《医疗器械***标识系统术语和定义》医疗器械行业标准意见的通知03关于征求《医疗器械***标识通用要求》医疗器械行业标准意见的通知04基于GS1标准的五一器械标识。 平台化操作简单采用UDI平台化产品,无需本地下载、安装,系统操作简便,只要一部电脑有网络就可以使用。
任何医疗器械产品都具有一定的使用风险,都可能因为当时科技水平的制约,实验条件的限制等因素,而在临床应用过程中存在一定的风险。所谓批准上市,是指社会、技术、伦理和法令皆可接受的基础上的认可,而并非***安全。被批准上市的医疗器械只是“受益大于风险”的“风险可接受”产品,即被批准上市产品在现有知识水平下,相对符合安全使用的要求。在按照预定的条件和用户使用时不会危及患者、使用者和其他人的临床状况(健康)和安全;2产品的设计和制造应符合公知的***技术水平可以达到的安全性原则;3使用该产品所可能发生的风险就其受益而言是可以接受的;4应按照以下顺序选择安全性解决方案:①尽可能消除或降低风险(从设计和构造上保证安全);②如果风险无法消除,应采取充分的保护措施,如必要时报警等;③将采取措施后仍残留的风险告知使用者。 轻质化应用采用轻质化的运用模式,厂商只需要输入产品名称和型号,就可以产生UDI。德阳UDI操作流程
批量完成产品udi编码,编码相关数据可同步药监部门数据库,无需再重复操作.梅州标识UDI实施
专业从事UDI医疗器械,兽药二维码,自动贴标机,后段包装设备的研究、开发、设计、制造、及生产经营为一体的实体企业。我们严格执行国家质量体系认证的标准生产、销售产品。公司是生产型企业,不断总结吸取国内外先进技术,结合市场需求,推出质量可靠、性能优异的包装设备,极大地满足了客户需求。近年来公司产品已经销售到国内各大市场中,我们凭借着先进的机械设备与过硬的技术收获了大量用户的认可与支持。慧翼科技凭借着以顾客为重心,以合理价格为客户提供满意的产品。公司已拥有专业的工程师,专业制造团队、销售团队,售后服务团队,拥有完善的售前、售中、售后服务体系。雄厚的技术力量支持和质量过硬的UDI医疗器械,兽药二维码,自动贴标机,后段包装设备产品是您放心的选择。梅州标识UDI实施
广州慧翼智能科技有限公司是以提供UDI医疗器械,兽药二维码,自动贴标机,后段包装设备为主的私营独资企业,公司成立于2011-08-04,旗下慧翼科技,已经具有一定的业内水平。公司承担并建设完成机械及行业设备多项重点项目,取得了明显的社会和经济效益。广州慧翼科技将以精良的技术、优异的产品性能和完善的售后服务,满足国内外广大客户的需求。
文章来源地址: http://yyby.chanpin818.com/ylqzzsb/deta_18644021.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。




 [VIP第1年] 指数:3
[VIP第1年] 指数:3