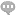新版药品GMP的特点首先体现在强化了软件方面的要求。一是加强了药品生产质量管理体系建设,大幅提高对企业质量管理软件方面的要求。细化了对构建实用、有效质量管理体系的要求,强化药品生产关键环节的控制和管理,以促进企业质量管理水平的提高。二是到位强化了从业人员的素质要求,江西SAP系统CSV认证。增加了对从事药品生产质量管理人员素质要求的条款和内容,进一步明确职责。细化了操作规程、生产记录等文件管理规定,增加了指导性和可操作性。在硬件要求方面,新版GMP提高了部分生产条件的标准。一是调整了无菌制剂的洁净度要求。为确保无菌药品的质量安全,新版GMP在无菌药品附录中采用了WHO和欧盟更新的A、B、C、D分级标准,江西SAP系统CSV认证,对无菌药品生产的洁净度级别提出了具体要求;增加了在线监测的要求,特别对悬浮粒子,也就是生产环境中的悬浮微粒的静态、动态监测,对浮游菌、沉降菌(生产环境中的微生物)和表面微生物的监测都作出了详细的规定。增加了对设备设施的要求。对厂房设施分生产区、仓储区、质量控制区和辅助区分别提出设计和布局的要求;对设备的设计和安装、维护和维修、使用、清洁及状态标识,江西SAP系统CSV认证、校准等几个方面也都作出具体规定。旦霆科技专业提供验证咨询、CSV认证及技术支持,**解答专业技术问题,欢迎您的垂询!江西SAP系统CSV认证
问:GAMP 5 软件系统包含哪几类?
答:其实有 5 类,但是主要是 3 个大类:***类: 操作系统,如 Windows 等,验证策略是不推荐做十分详细的验证,记录版本。第二类:可配置软件包,如 OpenLAB ECM, LIMS, CSD 软件,需要做确认针对于用户需求的操作和供应商评估确认。第三类:完全定制化软件,需要审计供应商和验证整个系统,通常制药实验室不常见。
问:IT基础设施在 CSV 验证中地位与作用
答:应用程序例如软件系统等,是搭建在IT基础网络设施,应以合适的方式进行适当的确认和记录应存档
问:验证计划( VP )主要包括哪些内容?
答:包括的内容如下:
系统概述与验证目标
系统与项目的范围
验证项目的人员角色与职责
定义/缩写/参考资料
验证原理/依据 和策略
法规风险分析结果
交付
项目进度
供应商管理
可接受标准 与系统释放
培训要求
文档管理
问:如何进行供应商评估确认?
答:GMP 相关性和对系统供应商进行合适的潜在风险的确认和评估是必要的,一般进行问卷调查,如果做得严格些,可以进行供应商现场审计。
江西SAP系统CSV认证旦霆科技对验证测试工程师进行培训拓展及考核晋级,为向客户提供更专业的CSV验证检测服务而不断迈进。
我们可以得出验证其实就是一次项目的过程,从规划开始,通过每个阶段的不同的计划、执行、报告从而**终完成整个验证的过程。同时又比项目多了一部分周期性的活动,就是PQ部分。软件系统经过***个周期的PQ后,系统开始上线运行,后续的就是经过不同周期的PQ,来确保系统经过长时间的运行后仍然满足我们**开始的各种需求。3.验证与确认(关键字:验证、确认)此前看到某位前辈关于验证与确认之关系的见解,不是很认同。我在上一章节中说明验证的整个过程,再来看看确认,确认一般我们可以认为是某人按照某个文档或者规格要求进行的结果的确认活动。比如IQ/OQ/PQ,我们所进行的就是按照文档一步一步进行操作,**终得出确认后的结论。又比如我们自己买个手机,按照手机供应商提供的各种文档去操作,**终确认出手机符合厂家描述的性能指标。总结验证其实就是一个项目加上其周期性活动,而确认是验证的一部分活动。所以不能将验证和确认同日而语,也不可将几本确认过程文档就当做是一次验证。4.计算机化系统验证框架(关键字:验证相关SOP、验证主计划、验证计划、风险评估)计划写这章的时候,我一直在纠结应该写到哪个层面,好像有太多的东西要写。
URS: user requirement specification 用户需求规格书,是指使用方对设备、厂房、硬件设施系统等提出的自己的期望使用需求说明,设计方依据这个需求等提出自己具体的方案,设备供应商依据客户提供的URS方案设计施工。
FAT: Factory Acceptance Test 工厂验收测试
SAT: Site Acceptance Test 现场验5收测试
DQ: Design Qualification 设计确认
IQ:Installation Qualification 安装确认
OQ:Operation Qualification 操作(运行)确认
PQ:Performance Qualification 性能确认
SOP: Standard operation procedure 标准作业程序
旦霆科技可提供CSV认证等验证检测服务。广纳良言,吸取客户有效意见、致力于为客户更好的服务。
问:旦霆科技在 CSV 验证上可以为客户到哪些?
我们在不同阶段都可以为您提供不同的帮助
1)项目计划计划:帮助您一起做好计划
2)需求沟通阶段:验证计划 VP,系统 GxP 影响性评估或法规风险分析,用户功能需求规范( URS/FRS ),风险评估报告( RA )
3)系统安装配置阶段:系统配置规范 CS
4)系统验证阶段:安装确认 IQ,运行确认 OQ,性能确认 PQ,需求追踪矩阵 RTM,验证总结报告 VSR
5)项目交付阶段:项目验收报告
问:旦霆科技 CSV 验证可以为客户实验室带来哪些利益?
答:旦霆科技的服务:
帮助发现系统的缺陷,从而即时整改,以达到符合 DI 相关法规要求
使得客户 QC/QA/IT 等人员,在验证过程中,可获得 CSV 验证相关培训
客户建立起相关 SOPs,便于系统放行后的运行和监控
加速了客户 CSV 验证的进程
总之,**降低了客户 CSV 法规风险,且加速了整个验证过程!
旦霆科技不断强化团队管理、品牌价值及服务升级,以质量的理念为企业提供高水准的CSV验证服务!江西SAP系统CSV认证
旦霆科技拥有先进的验证理念,成熟的验证体系,为您提供专业、质量的计算机化系统验证服务。江西SAP系统CSV认证
类别4可配置软件产品
可配置软件产品提供了标准化的界面和功能,以使配置适合用户的具体业务流程。这通常会需要配置预先设定的软件模块。
很多和软件相关的风险都是由系统为符合客户具体业务流程要求所采用的配置决定的。采用新软件和软件升级都可能增加风险。
对于可配置产品而言,详细的URSs 是必要的。应该对供应商和可配置软件采用基于风险的评估方法,这一方法应以文件形式存档。
虽然用户可能没有功能规范(简称FSs) ,但是应该有适当的规范来保证可追溯性和足够的测试覆盖面。验证应该保证软件产品符合用户需求,且关注于可配置的业务流程。定制模块应该按类别5 中的组件处理。
江西SAP系统CSV认证
旦霆生物科技(上海)有限公司是一家为制药、化工、化妆品、保健食品、制药设备等行业提供GXP合规咨询、验证服务以及培训的综合性咨询公司;
旦霆公司长期致力于帮助企业顺利通过FDA EU TGA WHO CFDA等机构的GMP认证检查;
公司成员多来自于**外资制药企业、外资GMP咨询公司、及国内**的第三方检测公司。
作为以慈善事业为使命的旦霆公司坚持以超值的品质为客户提供服务,同时公司每年利润的10%捐献给中国贫困儿童,持久资助中国贫困儿童的教育。
文章来源地址: http://yyby.chanpin818.com/qtflft/deta_9922413.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。




 [VIP第1年] 指数:3
[VIP第1年] 指数:3